
| III: Fluoreszenztechniken I (INHALT) |
 |
| HIGHRES 143 KByte |
| Immunhistochemie mit Fluoreszenzfarbstoffen | |
|---|---|
|
Für die mikroskopische Untersuchung der Zellen in einem Gewebe wird das Gewebe zunächst präpariert,
fixiert, eingebettet und geschnitten (siehe: Herstellung von Dünnschnitten).
Die meisten Gewebe bestehen aus einer Vielzahl unterschiedlicher Zelltypen, und die Immunhistochemie macht es möglich,
einzelne Zelltypen im Gewebe darzustellen. Dieser Vorgang wird hier am Beispiel der Netzhaut beschrieben.
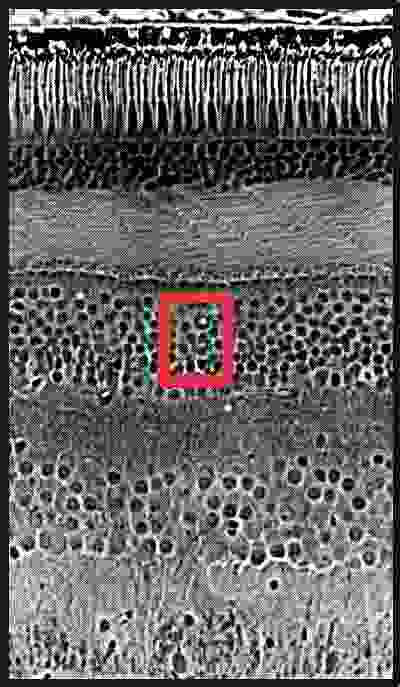
Die Netzhaut (Retina) von Säugetieren zeigt eine geschichtete Struktur, aufgebaut aus mehreren Klassen von Neuronen, die zusammen die erste Verarbeitung der visuellen Information leisten. Die Zellklassen sind Photorezeptoren, Horizontalzellen, Bipolarzellen, Amakrinzellen und Ganglienzellen, und zu jeder Klasse gehören mehrere unteschiedliche Zelltypen (Beschreibung der Netzhaut). Beispiel: In der rot markierten Schicht, der inneren nukleären Schicht, befinden sich mehrere Typen von Bipolarzellen, eine Vielzahl unterschiedlicher Amakrinzellen sowie Horizontalzellen. Wie kann man einzelne, definierte Zelltypen identifizieren? Eine Subpopulation von Bipolarzellen exprimiert das Protein Recoverin. Einige Typen von Amakrinzellen benutzen Dopamin als Neurotransmitter und besitzen deshalb das Enzym Tyrosinhydroxylase, das für die Biosynthese von Dopamin gebraucht wird. Andere Amakrinzellen verwenden das Enzym Cholinacetyltransferase für die Biosynthese ihres Transmitters Acetylcholin. Für alle drei Proteine stehen den Anatomen Antikörper zur Verfügung, die für eine Immunfärbung dieser Subpopulationen von Bipolarzellen und Amakrinzellen eingesetzt werden können. Unten ist am Beispiel der Amakrinzellen dargestellt, wie eine Doppelfärbung von zwei Zelltypen im selben Gewebe durchgeführt wird. Aus: Boycott, B.B., Dowling, J.E. (1969) Die Unterkante des Bildes entspricht etwa 250 mm. |
|
| Fluoreszenzfärbung mit Antikörpern |
|---|
|
Dopaminerge und cholinerge Amakrinzellen sollen mit Antikörpern gegen Tyrosinhydroxylase bzw Cholinacetyltransferase identifiziert werden. Da beide Enzyme im Zytoplasma der Amakrinzellen vorliegen, werden die Zellen zunächst mit einem Detergenz (zB Triton X-100) permeabilisiert, um den Antikörpern den Zugang zum Zytoplasma zu ermöglichen. 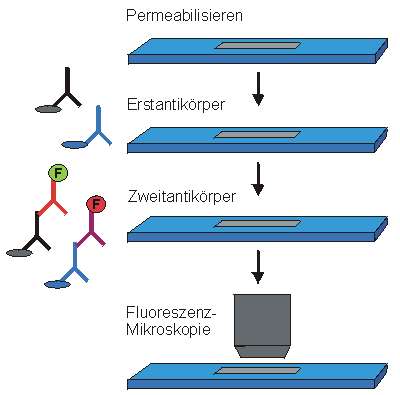
Dann werden die Erstantikörper auf den Schnitt gegeben. Dabei ist wichtig, daß die beiden Antikörper in Tieren unterschiedlicher Gattungen produziert worden sind, zB anti-Tyrosinhydroxylase (hier blau) im Kaninchen und anti- Cholinacetyltransferase (hier schwarz) im Esel. Nach einem Waschgang bleiben nur dort Antikörper zurück, wo sie an ihr jeweiliges Antigen gebunden sind - also die einen an den dopaminergen die anderen an den cholinergen Amakrinzellen. Nun werden die Zweitantikörper zugegeben, die gegen Proteine der Tiere gerichtet sind, von denen die Erstantikörper stammen. Die anti-Esel-Zweitantikörper sind mit einem grünen Fluorochrom konjugiert und bindet an die anti-Cholinacetyltransferase- Erstantikörper (schwarz). Die anti-Kaninchen-Zweitantikörper markieren die anti-Tyrosinhydroxylase-Erstantikörper (blau) und tragen ein rotes Fluorochrom. Nach Abwaschen der nicht-gebundenen Antikörper kann nun mit dem Fluoreszenzmikroskop die Verteilung der Immunfärbung im Gewebeschnitt untersucht werden. Dabei muß das optische System so eingerichtet sein, daß Anregungs- und Emissionslicht der beiden Fluorochrome gut voneinender getrennt sind. Nur dann ist eine getrennte Darstellung der beiden Signale möglich. Eine gute Kombination von Fluoreszenzfarbstoffen ist: Grünes Fluorochrom: FITC Anregung 490 nm (blau), Emission 520 nm (grün) Rotes Fluorochrom: Texas Red Anregung 580 nm (gelb), Emission 620 nm (rot). |
| Subpopulationen von Bipolarzellen und Amakrinzellen |
|---|
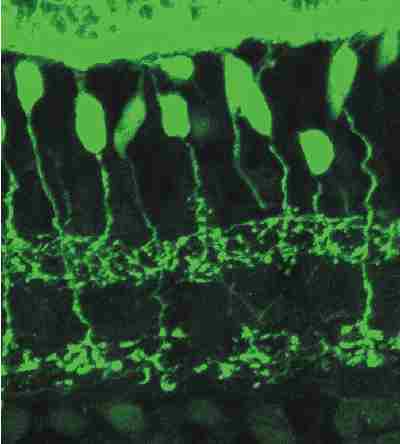 Anfärbung eines vertikalen Schnittes der Netzhaut mit einem anti-Recoverin-Antikörper. Am oberen
Bildrand sieht man die Zellkörper der Photorezeptoren, die alle Recoverin exprimieren.
In der inneren nukleären Schicht darunter wird Recoverin nur in einer Subpopulation von Bipolarzellen
exprimiert, die hier grün angefärbt ist. Alle anderen Bipolarzellen sind ungefärbt. Sie
füllen den schwarzen Zwischenraum zwischen den angefärbten Zellen.
Anfärbung eines vertikalen Schnittes der Netzhaut mit einem anti-Recoverin-Antikörper. Am oberen
Bildrand sieht man die Zellkörper der Photorezeptoren, die alle Recoverin exprimieren.
In der inneren nukleären Schicht darunter wird Recoverin nur in einer Subpopulation von Bipolarzellen
exprimiert, die hier grün angefärbt ist. Alle anderen Bipolarzellen sind ungefärbt. Sie
füllen den schwarzen Zwischenraum zwischen den angefärbten Zellen.
Auch die Axone der Bipolarzellen sind angefärbt. Man kann deutlich erkennen, daß die Axone in zwei unterschiedlichen Schichten enden. Manche Bipolarzellen haben die synaptischen Endigungen ihrer Axone (das Axonterminalsystem) im oberen, andere Bipolarzellen im unteren Bereich der inneren plexiformen Schicht. Durch Fluoreszenzmarkierung von Proteinen, die spezifisch für einen bestimmten Zelltyp sind, können die Zellen dieses Typs also im Fluoreszenzmikroskop dargestellt werden. |
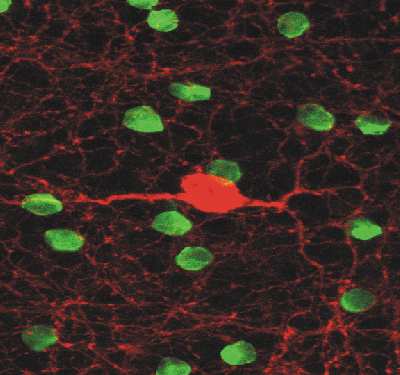 Hier sieht man eine Immunfärbung mit fluorochrom-markierten Antikörpern gegen
Tyrosinhydroxylase (rot) und Cholinacetyltransferase (grün). Dargestellt ist
ein horizontaler optischer Schnitt durch die Netzhaut, der die innere nukleäre und Teile der
darunterliegenden inneren plexiformen Schicht unfasst.
Bei den grün angefärbten cholinergen Amakrinzellen sieht man nur die Zellkörper, die
Dendriten sind aus Gründen der Übersichtlichkeit nicht dargestellt. Bei der rot gefärbten dopaminergen Amakrinzelle dagegen
kann man neben dem Zellkörper ein dichtes Netzwerk von Dendriten erkennen, das die gesamte nukleäre
Schicht durchzieht.
Hier sieht man eine Immunfärbung mit fluorochrom-markierten Antikörpern gegen
Tyrosinhydroxylase (rot) und Cholinacetyltransferase (grün). Dargestellt ist
ein horizontaler optischer Schnitt durch die Netzhaut, der die innere nukleäre und Teile der
darunterliegenden inneren plexiformen Schicht unfasst.
Bei den grün angefärbten cholinergen Amakrinzellen sieht man nur die Zellkörper, die
Dendriten sind aus Gründen der Übersichtlichkeit nicht dargestellt. Bei der rot gefärbten dopaminergen Amakrinzelle dagegen
kann man neben dem Zellkörper ein dichtes Netzwerk von Dendriten erkennen, das die gesamte nukleäre
Schicht durchzieht.
Diese fluoreszenzoptischen Aufnahmen wurden mit einem Laserscanning-Konfokalmikroskop von Dr. Frank Müller im Forschungszentrum Jülich gemacht. Weiter Beispiele für Immunhistochemie der Netzhaut finden Sie auf Frank Müllers Homepage. |