
| IV: Fluoreszenztechniken II (INHALT) |
 |
| HIGHRES (70 kbyte) |
Quenching der SPQ-Fluoreszenz Anregung mit gepulsten Lasern Time-correlated single-photon counting Beispiel für eine FLIM-Messung |
|
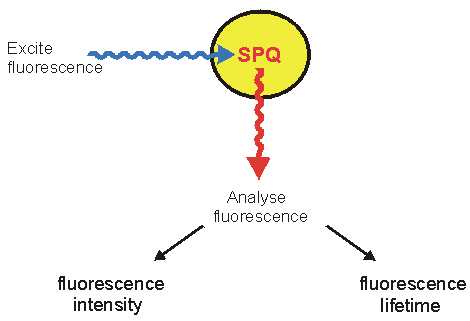
Das FLIM-Prinzip:
Bei der FLIM-Technik verwendet man ionensensitive Fluoreszenzfarbstoffe zur Messung intrazellulärer Ionenkonzentrationen. Man nutzt die Tatsache, daß sich die Fluoreszenz-Lebenszeit, die mittlere Verweildauer der Elektronen im angeregten Zustand, mit der Ionenkonzentration ändert. Das Prinzip ist hier am Beispiel des chloridsensitiven Frabstoffs SPQ dargestellt. Eine Zelle wird mit SPQ gefüllt, der Farbstoff wird mit UV-Licht angeregt, und die Fluoreszenzemission wird gemessen. Es gibt zwei grundsätzlich verschiedene Methoden, dieses Fluoreszenzsignal zu analysieren: Auswertung der Fluoreszenzintensität (unten links) und Auswertung der Fluoreszenz-Lebenszeit (unten rechts). Beide Messparameter sind abhängig von der Ionenkonzentration (hier der Cl-- Konzentration), aber die Lebenszeit enthält wesentlich mehr Information (siehe unten). |
|
|
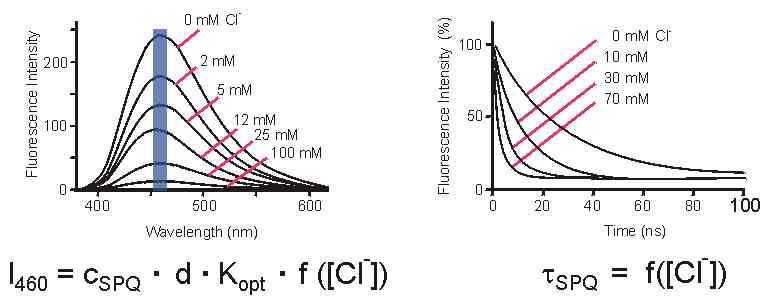
| 1. Fluoreszenzintensität: Bei Anregung mit UV-Licht (340 nm) emittiert SPQ blaues Fluoreszenzlicht. Das Emissionsspektrum zeigt ein Maximum im Bereich von 460 nm. Die Fluoreszenzintensität (die Helligkeit) ist am höchsten in Cl--freier Lösung; je höher die Cl-- Konzentration desto schwächer die Fluoreszenz (Warum? siehe: Quenching der SPQ-Fluoreszenz). Es ist jedoch nicht möglich, aus der gemessenen Fluoreszenzintensität auf die Cl--Konzentration zu schließen, denn die Intensität bei 460 nm (I460) hängt nicht nur von der Cl--Konzentration sondern auch von der Konzentration des Farbstoffs (cSPQ), der Dicke der Zelle (d) sowie einer Reihe optischer Parameter ab (Transmission der Mikroskoplinsen, Intensität des Anregungslichtes, Extinktionskoeffizient und Quantenausbeute von SPQ, etc...), die hier als Kopt zusammengefasst sind. Da alle diese Parameter im allgemeinen unbekannt sind, kann die Cl--Konzentration aus I460 nicht berechnet werden. |
2. Fluoreszenz-Lebenszeit: Zur Ermittlung der Fluoreszenz-Lebenszeit wird die SPQ-gefüllte Zelle
zunächst belichtet, um p-Elektronen des Farbstoff anzuregen (siehe
Jablonski-Diagramm). Nach Abschalten des Anregungslichts verweilen die Elektronen
eine gewisse Zeit (Lebenszeit) im angeregten Zustand und kehren dann zum Grundzustand zurück, wobei pro Elektron
ein Fluoreszenzphoton emittiert wird. Die meisten Elektronen haben nur eine kurze Lebenszeit im angeregten
Zustand (nur wenige Nanosekunden; 1 ns = 10-9 s). Bei manchen dauert es aber viele ns, bis sie in
den Grundzustand zurückfallen und Fluoreszenz erzeugen. Weil die meisten Elektronen eine kurze Lebenszeit haben,
ist die Fluoreszintensität nach Abschalten des Anregungslichtes (Zeitpunkt 0 im Diagramm) am Anfang relativ stark,
wird dann aber immer schwächer, weil längerlebige Elektronen im angeregten Zustand
seltener sind als kurzlebige. Das Abklingen der Fluoreszenzintensität wird durch eine einfache Exponentialfunktion
beschrieben: I(t) = I(t=0) * e-t/t. Die Zeitkonstante tSPQ
ändert sich mit der Cl--Konzentration: je höher die Cl--Konzentration desto kleiner
tSPQ, desto schneller klingt die Fluoreszenz nach dem Abschalten des Anregungslichtes ab.
Warum tSPQ Cl--abhängig ist, wird auf der Seite Quenching der SPQ-Fluoreszenz
erklärt. Hier ist wichtig, daß tSPQ nur von der Cl--Konzentration
abhängt und nicht von Farbstoffkonzentration, Zelldicke oder anderen Parametern. Hat man tSPQ
bestimmt, kann man also die Cl--Konzentration berechnen.
Durch die zeitaufgelöste Analyse der Fluoreszenzintensität kann man daher absolute Konzentrationen von allen Ionen bestimmen, für die selektive Fluoreszenzfarbstoffe zur Verfügung stehen. |