|
|
Die Spezifität von Riechzellen ist darauf zurückzuführen, dass Rezeptorproteine
in der Plasmamembran der Zilien Duftstoffe abhängig von ihren strukturellen
Eigenschaften mit variierender Affinität binden. Jede Riechzelle stellt
vermutlich nur einen oder wenige Typen von Duftstoffrezeptoren her. Beim
Menschen codiert eine aus 500 bis 1000 Genen bestehende Multigenfamilie
für Duftstoffrezeptoren.
Die Duftstoffrezeptoren gehören zur Superfamilie der G-Protein-gekoppelten
Rezeptoren. Sieben hydrophobe Domänen durchspannen die Ziliarmembran wahrscheinlich
als a-Helices. Aminosäurenreste mit hoher Variabilität sind in Abb. 1
schwarz markiert. Möglicherweise sind diese hypervariablen Regionen an
der Bindung von Duftstoffmolekülen beteiligt.
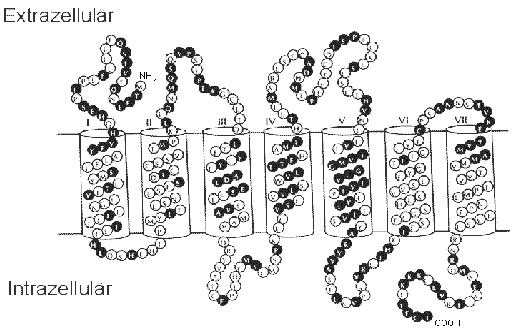 |
Abb. 1 Aminosäurensequenz und Strukturvorschlag
eines Duftstoffrezeptors
aus: K. J. Ressler, S. L. Sullivan, L. B. Buck, A molecular dissection
of spatial patterning in the olfactory system, Current Opinion in
Neurobiology 4, 588-596 (1994). |
|
|
|
Die hohe Empfindlichkeit einer Riechzelle für spezifische Duftstoffe wird
ermöglicht von intrazellulären Signalverstärkungsmechanismen, die auf
second messenger-Kaskaden beruhen. Bisher am besten bekannt ist der von
zyklischem Adenosinmonophosphat (cAMP) vermittelte Transduktionsweg (Abb.
2) :
Der Duftstoff-Rezeptor-Komplex in der Zilienmembran aktiviert ein olfaktorisches
GTP-bindendes Protein Golf, das das membranständige Enzym Adenylatzyklase
(AC) stimuliert. Die in Riechzellen auftretende Isoform AC Typ III besitzt
eine besonders hohe enzymatische Aktivität im stimulierten Zustand, wodurch
die intrazelluläre cAMP-Konzentration signifikant moduliert werden kann.
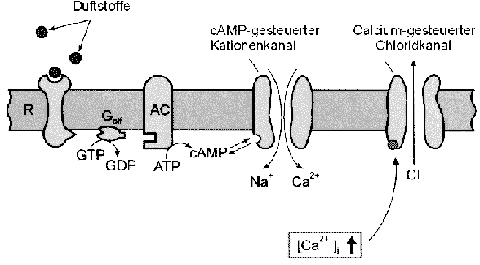 |
Abb. 2 Signaltransduktion in Riechzellen über eine vom second messenger
zyklisches AMP (cAMP) vermittelte Kaskade
aus: Homepage Stephan Frings, Institut für Biologische Informationsverarbeitung,
Forschungszentrum Jülich http://www.fz-juelich.de/ibi/ibi-1/stefring.htm
(Vorlesungsskripte Zoophysiologie/Signalverarbeitung in Riechzellen/
chemoelektrische Transduktion/Erzeugung des Rezeptorstroms) |
Bei Erhöhung der cAMP-Konzentration öffnen unspezifische Kationenkanäle
in der Zilienmembran, die zur Superfamilie der von zyklischen Nukleotiden
gesteuerten Ionenkanäle (CNG-Kanäle) gehören. Der Eintritt von Calciumionen
aus dem Mukus durch die cAMP-gesteuerten Kanäle in die Zilien erhöht die
intrazelluläre Konzentration an freien Calciumionen ([Ca2+]i). Der Anstieg
des Ca2+-Spiegels öffnet Ca2+-gesteuerte Chlorid-Kanäle, die Chloridionen
(Cl-) aus den Zilien in den Mukus leiten. Durch den Kationeneinstrom und
den Anionenausstrom depolarisiert die Riechzelle. Am Axonhügel werden
die lokalen Potentiale in eine Erhöhung der Frequenz der Aktionspotentiale
umgesetzt.
Außerdem scheint Inositol-1,4,5-trisphosphat (IP3) an der olfaktorischen
Signaltransduktion beteiligt zu sein, zum gegenwärtigen Zeitpunkt ist
die Funktion dieses Botenstoffes allerdings noch nicht verstanden.
|
|
|
Zur Unterbrechung der Signalkaskaden wirken Terminationsmechanismen auf
die molekularen Komponenten der olfaktorischen Transduktion ein.
Die Erhöhung der Calciumionen-Konzentration in den Zilien führt unter
Beteiligung des Calciumionen bindenden Proteins Calmodulin zur Inhibition
der cAMP-gesteuerten Kationenkanäle, außerdem wird eine Phosphodiesterase
aktiviert, die den cAMP-Spiegel absenkt. Die intrazelluläre Calciumionen-Konzentration
wird durch Na+/Ca2+-Austauscherproteine gesenkt, sekundäre Transporter,
die den Calciumionen-Ausstrom durch Kopplung an Natriumionen-Einstrom
ermöglichen. Natriumionen werden unter ATP-Hydrolyse von einer Na+/K+-ATPase
aus den Zilien gepumpt.
Die Deaktivierung des Duftstoffrezeptors könnte herbeigeführt werden durch
Phosphorylierung entweder über multifunktionelle Proteinkinasen wie Proteinkinase
A und Proteinkinase C oder über spezifische G-Protein-gekoppelte Rezeptorkinasen.
Möglicherweise ist auch eine Isoform des Proteins b-Arrestin, BARR-2,
involviert, die in Zilien gefunden wurde.
|



