Nach der Solubilisierung gilt es durch weitere Anreicherungsverfahren das Zielprotein rein
darzustellen, d.h. alle anderen Proteine abzutrennen. Hierzu werden oft chromatographische
Methoden benutzt wie bspw.:
Ausschluss-Chromatographie, Ionenaustausch-Chromatographie und Affinitäts-Chromatographie.
Bei der Ausschluss-Chromatographie werden die Proteine entsprechend ihrer Größe über Säulenmatrizes
mit verschiedenen Maschenweiten aufgetrennt. Die Porengröße des Säulenmaterials bestimmt, welche
Proteine zurückgehalten werden bzw. welche Proteine im Ausschlussvolumen von der Säule eluieren.
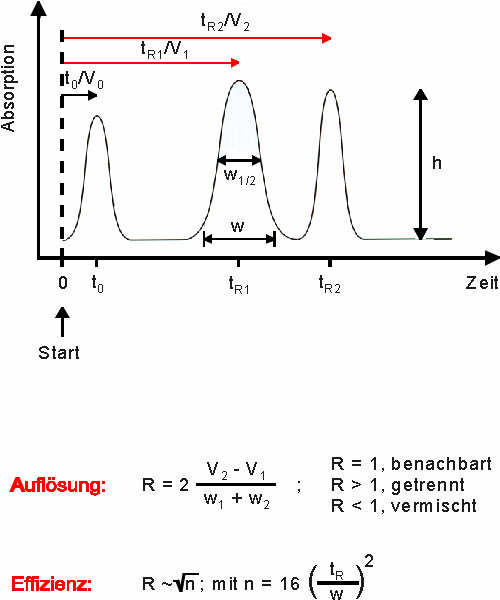
Ein typisches Chromatogramm ist nebenstehend abgebildet. Nach dem Auftrag auf die Säulenmatrix
vergeht einige Zeit bis die ersten Proteine die Säule im Ausschluss-Volumen (V0, t0) verlassen.
Proteine, die von der Matrix zurückgehalten werden, eluieren zu späteren Zeitpunkten. Die Zeit,
die diese Proteine bis zur Elution auf der Säule verbringen, wird als Retentionszeit (tR) bezeichnet. Das Auflösungsvermögen der Säule bestimmt darüber, ob zwei Proteine chromatographisch voneinander getrennt werden können (s. Diagramm; tR1 und tR2). Für das Auflösungsvermögen ist u.a. die Zahl der theoretischen Böden (n) entscheidend. Je mehr theoretische Böden vorhanden sind desto besser ist die Effizienz der Trennung. Da die aromatischen Aminosäuren der Proteine im UV-Bereich absorbieren, kann die chromatographische Trennung spektroskopisch verfolgt werden.
(Abb. aus "Bioanalytik", Lottspeich und Zorbas, Spektrum Verlag)
|
|


