|
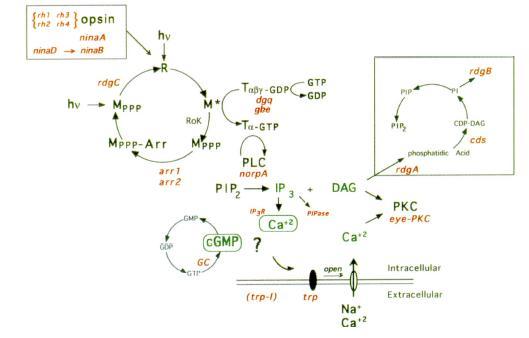
Die Abbildung zeigt schematisch und stark zusammenfassend die Signalkaskade, wie sie bei Drosophila abläuft. Die in rot wiedergegeben
Angaben geben das codierende Gen der jeweiligen Komponente an. Durch die Absorption von Photonen isomerisiert der in das Rhodopsinmolekül
(R) eingelagerte Chromophor 11-cis-Retinal zu all-trans-Retinal. Dieser Vorgang löst eine Konformationsänderung im Rhodopsinmolekül aus und aktiviert seine katalytischen Fähigkeiten. Im aktivierten Zustand (M*) ist
es in der Lage, ein G-Protein (T-GDP) zu binden und katalysiert dessen Aktivierung. Das G-Protein tauscht sein GDP gegen ein GTP und zerfällt in einen -Komplex und die aktive Untereinheilt G-GTP. G-GTP
aktiviert das Enzym Phosphlipase C (PCL), welches die Hydrolyse des Membranphospholipids Phosphatidylinositol (PIP2) zu Inositoltriphosphat (IP3) und Diacylglycerol
(DAG) katalysiert. IP3 und DAG stellen intrazelluläre Botenstoffe dar, welche die Öffnung der Kationenkanäle bewirken. Diese Kanäle wirken nicht spezisch auf ein Kation, aber sie lassen in erster Linie Ca2+
-Ionen in die Zelle einströmen. Der Kationeneinstrom löst eine Depolarisation der Zelle aus. Es wird vermutet, daß auch cGMP als intrazellulärer Botenstoff bei der Depolarisation eine Rolle spielt. Eng mit der Aktivierung ist die
Regulation der Zellantwort verbunden. Die dabei ablaufenden Mechanismen sind jedoch noch nicht vollständig untersucht worden. Versuche haben gezeigt, das extrazelluläres Calcium für das schnelle Ablaufen der Signalkaskade
verantwortlich ist. Bringt man Sehzellen in ein calciumarmes Millieu, verlaufen sowohl Aktivierung und Deaktivierung des Prozesses sehr langsam, während der Prozess in calciumreichem Millieu sehr schnell abläuft. Bekannte
Regulationsprozesse, an denen Ca2+ beteiligt ist, sind die Aktivierung von Calmodulin und zusammen mit DAG die Aktivierung einer für Augen spezischen Protein-Kinase C (PKC). PKC ist an der Deaktivierung und
Desensibilisierung der Zellantwort entscheidend beteiligt, z.B. phosphoriliert es aktive Zwischenprodukte der Signalkaskade und deaktiviert sie dadurch. Um welche Zwischenprodukte genau es sich dabei handelt, ist noch nicht
bekannt. Das aktivierte Rhodopsinmolekül (M*) wird in einer Lichtreaktion sehr schnell wieder in seine inaktive Form (R) überführt, so daß es für eine erneute Reaktion zur Verfügung steht. Dabei wird M* von einer
Rhodopsin-Kinase (RoK) phosphoriliert und bindet mit Arretin Das inaktivierte Rhodopsin wird durch eine Lichtreaktion in seine Ausgangskonformation zurückgefülhrt und durch eine Phosphatase
dephosphoriliert. Auch PIP2 wird regeneriert, indem es über mehrere Zwischenschritte aus DAG wiederhergestellt wird. Die Phototransduktion von Drosophila ist die schnellste bekannte Signalkaskade, die an ein G-Protein
gekoppelt ist. Nur wenige Millisekunden liegen zwischen der Lichtaktivierung und der Depolarisation. Diese Organisation gewährleistet die hohe zeitliche Auflösung, zu der das Insektenauge in der Lage ist. Dazu müssen die einzelnen
Komponenten, die an der Kaskade beteiligt sind rämlich sehr eng beieinanderliegen und zum Zeitpunkt der Reaktion am entsprechenden Ort der Reaktion versammelt sein. Entsprechende Rahmenproteine sorgen dafür, das dies der Fall ist.
|
|
|
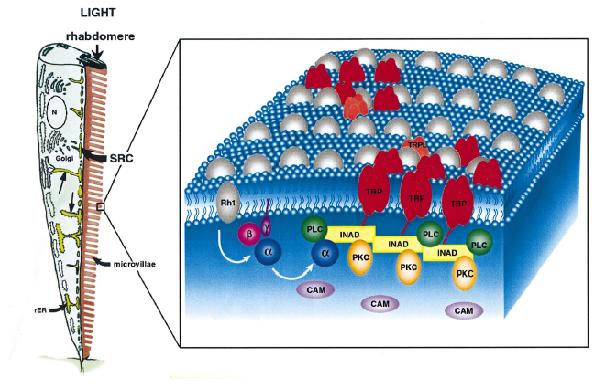
Die Organisation des Transduktionsweges wird durch durch Rahmenproteine gewährleistet. Bei Drosophila werden die einzelnen Komponenten der
Signalverarbeitung durch das Rahmenprotein INAD gesammelt und zu einem INAD-Transduktionskomplex vereinigt. INAD enthält insgesamt 5 verschiedene Proteinbindemotive (PDZ), die spezifisch an einen Partner binden. So bindet z.B. der
Kationenkanal an der PDZ-Domäne 3, PKC an PDZ-2 und PDZ-4, PLC an PDZ 1 und PDZ-5. Die Zellantwort wird dadurch in einem klar begrenzten Bereich der Zelle gehalten, und die Signalmoleküle gelangen in große räumliche Nähe zueinander
und werden von anderen Abläufen in der Zelle getrennt. Auf diese Weise wird eine schnelle Interaktion der einzelnen Partner gewährleistet. Schnelle Interaktion und Regulation der Zellantwort sind Voraussetzung für das hohe
zeitliche Auflösungsvermögen fliegender Insekten. Aufgrund der Anordnung der Signalmoleküle in eine klar begrenzte Mikrodomäne, werden bereits geringfügige Änderungen der Konzentration der sekundären Botenstoffe registriert. Die
Photorezeptorzellen weisen somit ein außerordentlich feines Regulationssystem auf, das in der Lage ist bereits geringfügige Photonenänderungen wahrzunehmen. |
|
|
Die Signalverarbeitung in Arthropodenaugen ist ein außerordentlich komplexer Prozeß, in dem Aktivierung und Deaktivierung der Zellantwort
eng miteinander verbunden sind. Rahmenproteine organisieren die beteiligten Komponenten in Transduktionskomplexe, und fördern dadurch einen extrem schnellen und ungehinderten Ablauf. Von den vermuteten 50 Genprodukten, die an der
Transduktion beteiligt sind, sind viele noch nicht genau untersucht worden, so daß die Transduktion noch nicht in allen Teilabläufen exakt beschrieben werden kann. Drosophila eignet sich auf sehr gut dazu, genetische und molekulare
Manipulationen an ihr durchzuführen, und stellt deshalb ein ideales Untersuchungsobjekt dar, in dem Sehzellen in vivo untersucht werden können. |
|
|
Tsunoda, Susan / Zucker, Charles. ”The organization of INAD-signaling complexes by a multivalent PDZ domain protein in Drosophila photoreceptor cells ensures sensitivity and speed
of signaling”. Cell Calcium 26 (1999), 165-171.
Zucker, Charles. ”The biology of vision in Drosophila”. Proc. Natl. Acad. Sci. USA 93 (1996), 571-576.
Abbildungen:
Abb. 1 und 2: Campbell, Neil A. 1997. Biologie. Heidelberg etc.: Spektrum
Abb. 3: www.stephanfrings.de
Abb. 4: Zucker, Charles. ”The biology of vision in Drosophila”. Proc. Natl. Acad. Sci. USA 93 (1996), 571-576.
Abb. 5: Tsunoda, Susan / Zucker, Charles. ”The organization of INAD-signaling complexes by a multivalent PDZ domain protein in Drosophila photoreceptor cells ensures sensitivity and speed of signaling”. Cell Calcium
26 (1999), 165-171.
|