|
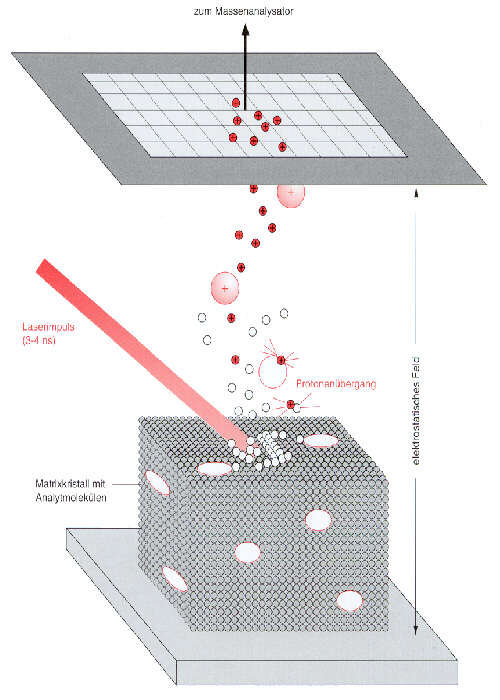
Bei der MALDI-Methode wird die Probe für wenige Nanosekunden mit kurzwelligem Laserlicht bestrahlt. Die elektronische Anregungsenergie führt zu einer lokalen Auflösung der Festkörperoberfläche (Matrix + Probe). Die Moleküle treten in die Gasphase über. Eine Elektrode, die sich in geringem Abstand gegenüber der Probe befindet, erzeugt ein elektrostatisches Feld. Je nach Polarität der Elektrode werden positive oder negative Ionen von der Probenoberfläche in Richtung des Analysators beschleunigt. Für MALDI-Untersuchungen werden Flugzeitmassenspektrometer (TOF, time of flight) als Analysatoren benutzt. Die Massenbestimmung erfolgt über die genaue Messung der Zeit, die zwischen dem Start der Ionen in der Probe bis zum Eintreffen am Detektor vergeht.
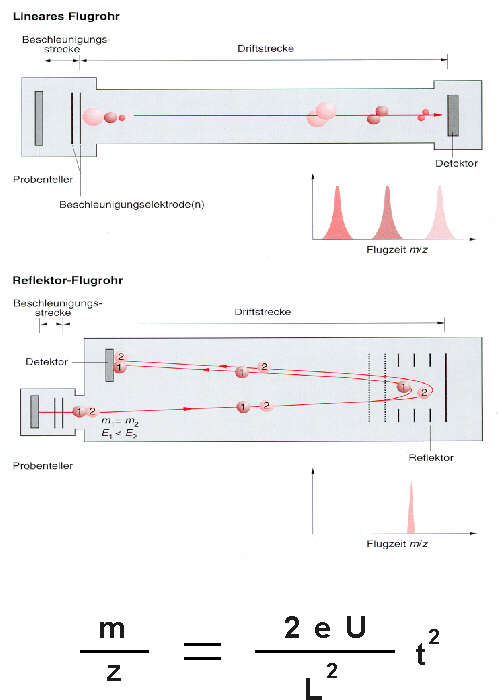
Ionen mit unterschiedlichen m/z-Werten werden, bei gleicher kinetischer Energie, in der Beschleunigungsstrecke auf unterschiedliche Geschwindigkeiten gebracht. Bei bekannter Beschleunigungsspannung (U) und Flugstrecke (L) der Ionen in der feldfreien Driftstrecke läßt sich durch Messung der Flugzeit der Ionen (t) das m/z-Verhältnis bestimmen. Die Kalibrierung erfolgt über Referenzsubstanzen mit bekannten Massen. Typische Flugzeiten bei der MALDI liegen zwischen wenigen bis einigen 100 µs. Die Driftstrecken sind 1 - 4m lang.
(Abbildungen aus: Lottspeich und Zorbas, "Bioanalytik", Spektrum Verlag, 1998)
|
|