
| XI: Vom Protein zum Gen II (INHALT) |
 |
| Eine der bekanntesten Methoden zur Bestimmung der Aminosäuresequenz ist der Edman-Abbau. Das Peptid (oder Protein) wird sukzessive vom N-Terminus um jeweils eine Aminosäure verkürzt. An die freie N-terminale Aminogruppe des Peptids wird Phenylisothiocyanat (PITC) gekoppelt. Dabei entsteht ein Phenylthiocarbanoylpeptid (PTC). In einer Nebenreaktion wird PITC alkalisch zu Anilin hydrolysiert. Das Anilin kann dann mit PITC zu Diphenylharnstoff (DPTU) reagieren. |
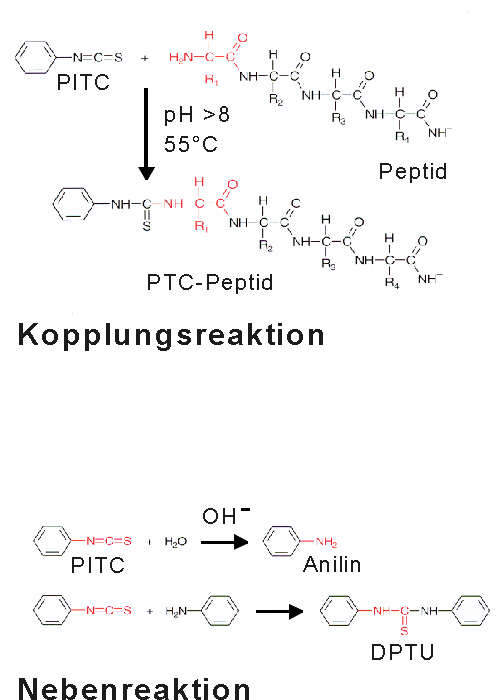
|
| Das PTC-Peptid wird in wasserfreier Säure (bspw. Trifluoressigsäure) gespalten. Es entsteht ein heterozyklisches Derivat der ersten Aminosäure, die Anilionothiazolinon (ATZ)-Aminosäure, und ein um eine Aminosäure verkürztes Peptid. Die relativ hydrophobe ATZ-Aminosäure wird extrahiert und in einem weiteren Schritt zu einem stabileren Derivat, der Phenylthiohydantoin (PTH)-Aminosäure konvertiert. |
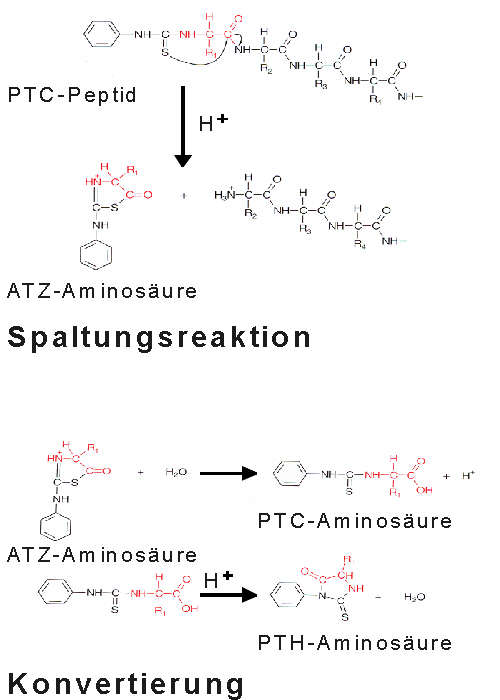
|
| Die PTH-Aminosäure wird chromatografisch im Vergleich zu den Rententionszeiten von Referenzproben identifiziert, die PTH-Derivate bekannter Aminosäuren enthalten. Somit ist die erste Aminosäure des Peptids bekannt. Das um eine Aminosäure verkürzte Peptid wird für einen weiteren Sequenzierungszyklus verwendet. Die Automatisierung des Edman-Abbaus ermöglicht heute durchschnittlich 30 - 40 Aminosäuren eines Peptids zu bestimmen. Die benötigten Peptidmengen liegen bei einigen 10 bis 100 pmol. (Abbildungen aus: Lottspeich und Zorbas, "Bioanalytik", Spektrum Verlag, 1998) |
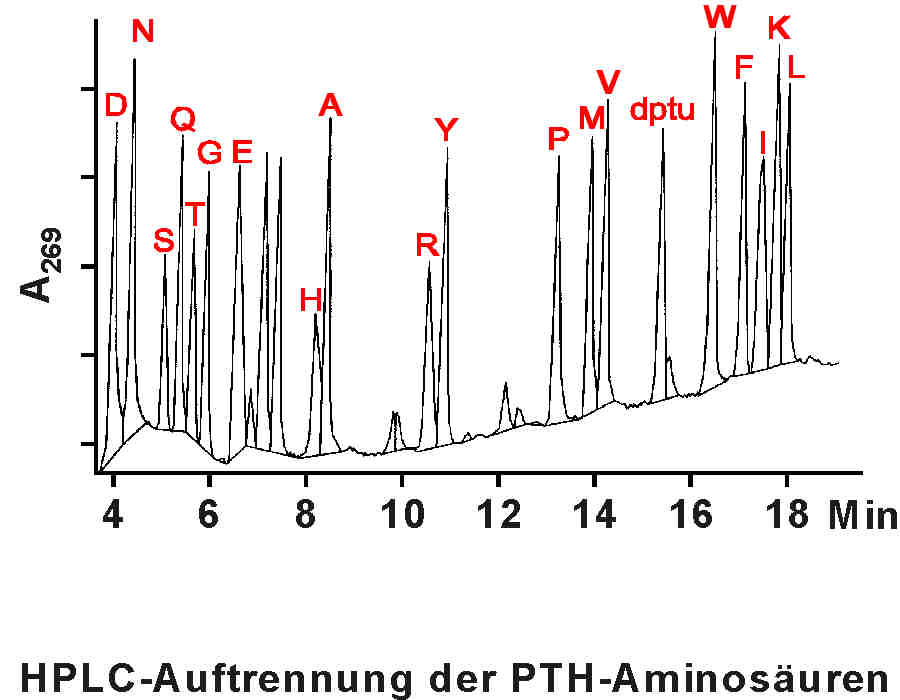
|