Aus: Zenner, H.P. und Zrenner, E. (1994)
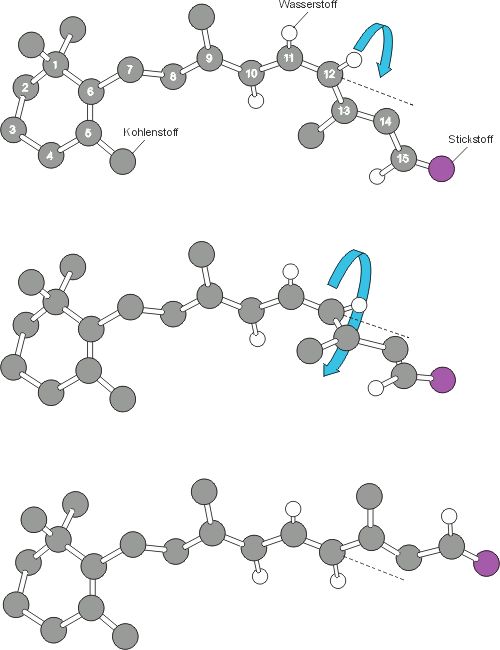
| Isomerisierung von Retinal | HIGHRES (127 kbyte) |
|---|---|
| Retinal, der Chromophor des Rhodopsins, ist ein Derivat des Vitamin A (Retinol).
Im Dunkeln liegt Retinal als 11-cis-Isomer vor (oben). Bei Absorption eines
Photons kommt es zur Isomerisierung des Moleküls: Durch eine Drehung der Bindung
zwischen dem 11. und 12. Kohlenstoffatom (Mitte) gelangt das Molekül in die
all-trans-Konfiguration (unten), die die Aktivierung des Rhodopsins auslöst. Im Dunkeln
isomerisiert all-trans-Retinal wieder in die 11-cis-Form
und verbindet sich mit einem Opsinmolekül zu Rhodopsin. Aus: Zenner, H.P. und Zrenner, E. (1994) |

|
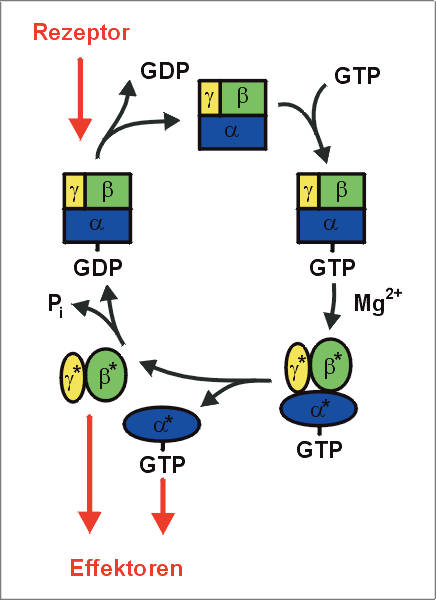
| DerReaktionszyklus von G-Proteinen | HIGHRES (116 kbyte) |
|---|---|
| Schematische Darstellung der Signalweiterleitung durch GTP-bindende Proteine.
Bei Stimulation einer Zelle wirkt eine Reiz (zB. Hormone, Transmitter, Licht) auf einen
Rezeptor und aktiviert das Rezeptorprotein.
Der aktivierte Rezeptor bindet ein GTP-bindendes Protein, das aus 3 unterschiedlichen
Untereinheiten besteht (heterotrimeres Protein) und im nicht-aktivierten Zustand GDP
gebunden hat. Die Bindung and den Rezeptor bewirkt zunächst den Austausch von
GDP gegen das energiereiche GTP. In Gegenwart von Mg2+, das im Zytoplasma immer ausreichend vorliegt, kommt es zu einer Konformationsänderung: das GTP-bindende Protein ist aktiviert. Jetzt trennen sich die Untereinheiten in a-GTP und den bg- Komplex. Beide Teile können die Aktivität von Zielproteinen, den Effektoren, regulieren. Nach kurzer Zeit hydrolysiert die a-Untereinheit das gebundene GTP zu GDP und anorgischem Phosphat (Pi). a-GDP bindet den bg-Komplex, und damit ist das G-Protein wieder inaktiv. Auf diese Weise werden extrazelluläre Signale in das Zellinnere überführt und dort in biochemische Reaktionswege eingeleitet. |
|