Postsynaptische Ca2+-Signale entstehen durch Ca2+-Einstrom und Ca2+-Freisetzung
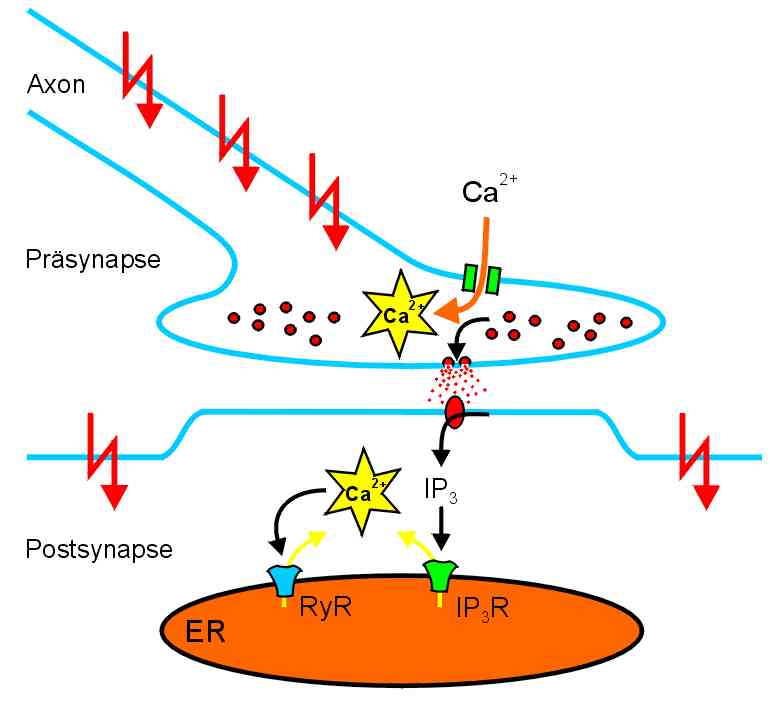
Postsynaptische Ca2+-Signale entstehen durch Ca2+-Einstrom und Ca2+-Freisetzung |
|---|

|
| Beim Eintreffen von Aktionspotentialen in der präsynaptischen Nervenendigung entsteht ein Ca2+-Signal durch Aktivierung spannungsgesteuerter Ca2+-Kanäle. Die dadurch ausgelöste Freisetzung von Neurotransmitter aktiviert metabotrope Rezeptoren in der postsynaptischen Membran. Einige dieser Rezeptoren aktivieren das Enzym Phospholipase C, das aus Phospholipiden der Plasmamembran den Botenstoff IP3 (Inositol-1,4,5-trisphosphat) abspaltet. IP3 aktiviert Ca2+-Kanäle in der Membran des endoplasmatischen Retikulums (ER), die sogenannten IP3- Rezeptoren. Da die Ca2+-Konzentration im Innern des ER weit höher (ca 100-1000 µM) ist als im Zytoplasma (ca. 0.1 µM), strömt Ca2+ aus dem ER, und es entsteht ein zytoplasmatisches Ca2+-Signal. Dieser Vorgang wird als Ca2+-Freisetzung (engl.: Ca2+-release) bezeichnet. In vielen Neuronen werden Ca2+-Signale durch eine zweite Art von Ca2+-Kanäle im ER verstärkt. Diese Ryanodinrezeptoren werden durch Bindung von Ca2+ aktiviert. Ca2+-Signale werden also durch eine positive Rückkopplung verstärkt, ein Prozess, der als Ca2+-induzierte Ca2+-Freisetzung (engl.: Ca2+-induced Ca2+ release, CICR) bezeichnet wird. CICR ist ein wichtiger Faktor bei der Entstehung von Ca2+-Wellen. |
Ca2+-Kanäle des endoplasmatischen Retikulums |
|---|
|
|
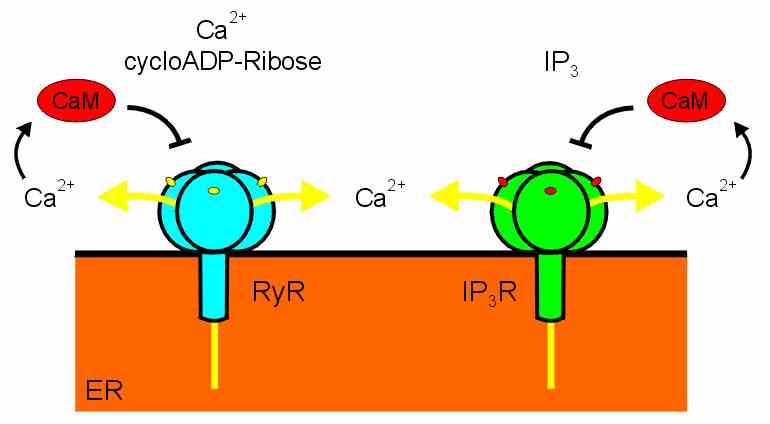
Ryanodinrezeptoren sind sehr große, tetramere Proteine (4 x 565 kDa).
Sie werden nicht durch IP3, wohl aber durch zytoplasmatisches Ca2+ und durch die
Botenstoffe cycloADP-Ribose (cADPR) und Nicotinsäure-Adenindinucleotidphosphat (NAADP) aktiviert.
Ryanodin, ein Alkaloid aus der Pflanze Ryana speciosa, aktiviert RyRs bei niedrigen, blockiert aber bei
hohen Konzentrationen. In physiologischen Experimenten können RyRs mit Koffein aktiviert und mit
Ruthenium-Rot blockiert werden.
IP3-Rezeptoren sind etwas kleiner als RyRs (4 x 313 kDa). IP3Rs können auch durch Ca2+ aktiviert werden, der wichtigste Aktivator ist aber IP3. cADPR, Ryanodin und Ruthenium-Rot wirken nicht auf IP3Rs, und Koffein hat nur einen schwachen Effekt. Heparin dagegen blockiert IP3Rs, nicht aber RyRs. Die hohe Ca2+-Konzentration im ER wird durch Ca2+-ATPasen aufrechterhalten. Ca2+- Bindeproteine wie Calsequestrin sorgen für eine hohe Speicherkapazität des ER-Lumens. Bei Aktivierung der Ca2+-Kanäle fließt Ca2+-Strom durch die Kanäle und erzeugt ein zytoplasmatisches Ca2+-Signal. Ähnlich wie bei den Ca2+- Kanälen der Plasmamembran wird der Ca2+-Strom durch Calmodulin abgeschaltet, das an die Kanäle bindet und sie inaktiviert. |