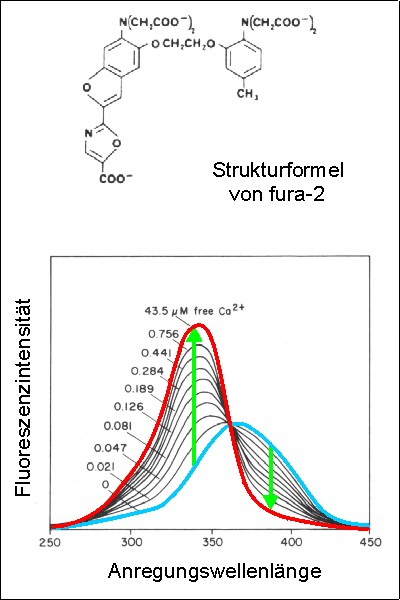
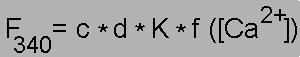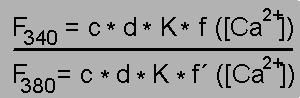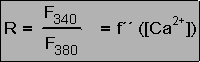Das fura-2 Molekül bindet Ca2+ mit vier Carboxylgruppen (ganz oben): fura-2 ist ein Ca2+-Chelator. Die Stilbengruppe (unten) ist der Chromophor des Moleküls. Dies Substanz ist sehr selektiv für Ca2+, und fast unempfindlich für pH-Schwankungen im physiologischen Bereich. Die Ca2+- Affinität ist sehr günstig für physiologische Messungen: Die Dissoziationskonstante ist etwa 0.25 µM, also genau in dem Bereich zellulärer Ca2+-Signale (0.1-1 µM).
Aus: Grynkiewiz et al., (1985)
Fluoreszenzemission von fura-2:
Hier ist die Fluoreszenzintensität von fura-2 bei Anregung mit ultraviolettem Licht dargestellt. Die Fluoreszenz ändert sich sowohl mit der Wellenlänge des Anregungslichts als auch mit der Ca2+-Konzentration. In Ca2+-freier Lösung wird das blaue Spektrum mit einem Maximum bei 365 nm gemessen. Bei hoher Ca2+-Konzentration verschiebt sich sich das Maximum auf 340 nm, und das rote Spektrum wird gemessen. Nur bei 360 nm, dem isosbestischen Punkt, ist die Fluoreszenz unabhängig von der Ca2+-Konzentration.
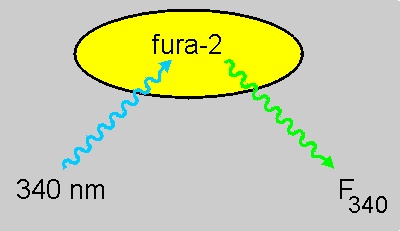
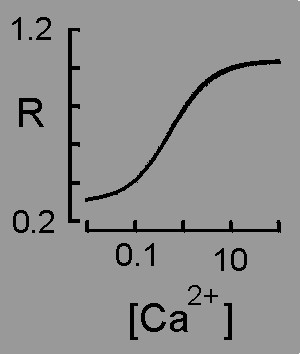
Bei Zugabe von Ca2+ zu einer fura-2-Lösung ergeben sich also zwei gegenläufige Änderungen der Fluoreszenzintensität (grüne Pfeile): Eine Zunahme bei 340 nm und eine Abnahme bei 380 nm. Auf diesem Effekt beruht die Verwendung von fura-2 zur Messung der Ca2+-Konzentration (siehe unten)
Aus: Haugland (1992)