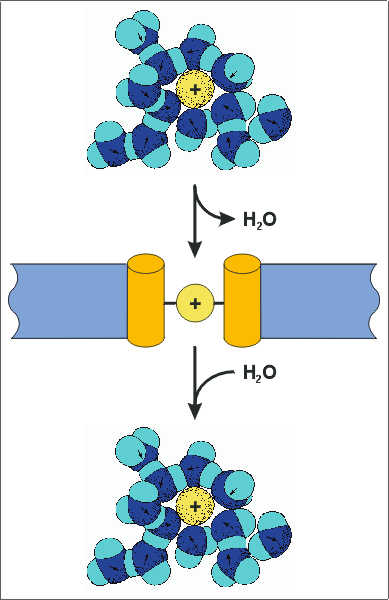
| Der Hydratmantel von Ionen | HIGHRES (102 kbyte) |
|---|---|
| Ionen liegen in wässriger Lösung nicht isoliert vor, sondern sie sind in einen Komplex von Wassermolekülen eingebunden, den sogenannten Hydratmantel. Die Wasserdipole sind darin elektrostatisch an das Ion gebunden. Hydratisierte Ionen gelangen im allgemeinen nicht durch die Poren von Ionenkanälen, weil der Porendurchmesser an der engsten Stelle nur wenig größer ist als das transportierte Ion. Eine Voraussetzung für den Ionen-fluß durch eine Kanalpore ist deshalb die Entfernung des Hydratmantels, die Dehydratation. Dazu muß die Energie der Wechselwirkung von Ion und Wasser (Hydratationsenergie) durch die Energie der Bindung des Ions an die Kanalpore (Bindungsenergie) ersetzt werden. Die Bindungsenergie wird von einer (oder mehreren) Bindestellen in der Pore bereitgestellt. Die Energiedifferenz [Bindungsenergie - Hyratationsenergie] entscheidet also darüber, ob ein Ion von einem Kanal über die Membran geleitet wird. Unterschiede in der Hydratationsenergie sind eine Grundlage der Ionenselektivität von Kanäle, die allein aufgrund der Ionengröße nicht zu erklären ist. | 
|
|
Ionensorte |
Durchmesser, (Angstrom) |
Hydratationsener- gie (kcal/mol) |
|
Na+ |
1.90 |
-105 |
|
Ca2+ |
1.98 |
-397 |
|
K+ |
2.66 |
-85 |
|
Cl- |
3.62 |
-82 |
Die Beschaffenheit der Bindestelle entscheidet darüber, welches Ion geleitet wird. Dasjenige Ion, das am besten in die geometrische Anordnung von Aminosäureresten der Bindestelle paßt, hat die höchste Bindungsenergie und kann deshalb am leichtesten seinen Wassermantel abstreifen.