Aus: de Duve, C. (1986)
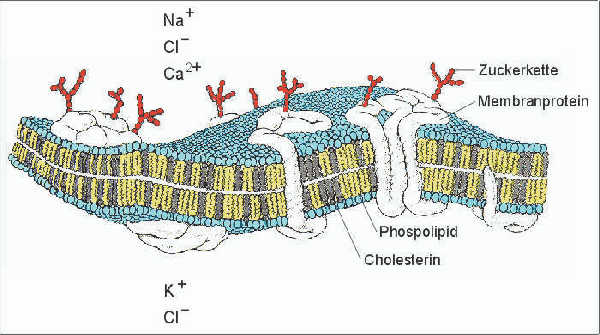
| Proteine in biologischen Membranen | HIGHRES (101 kbyte) |
|---|---|
| Biologische Membranen sind eine sehr effiziente Diffusionsbarriere für
Ionen. Der hydrophobe innere Bereich der Membran verhindert den Zugang von
Ionen und ermöglicht damit das Aufrechterhalten von Ionengradienten
zwischen Zytoplasma (10 mM Na+, 140 mM K+, 5-30 mM
Cl-, 10-8 M Ca2+) und Außenlösung
(140 mM Na+, 5 mM K+, 120 mM Cl-, 1.5 mM
Ca2+). Aus: de Duve, C. (1986) |

|
| Membranstruktur von Ionenkanälen | HIGHRES (82 kbyte) |
|---|---|
| Ionenkanäle durchsspannen die Membran mit meist mehreren Proteinsegmenten. Die trans-membranalen Segmente (S1, S2,. ..) enthalten viele hydrophobe und wenig hydrophile Aminosäurereste. Außerhalb der Membran finden sich überwiegend polare und geladene Aminosäuren. Ein spezielles Proteinsegment (P-Region) trägt zur Auskleidung der Pore bei. Hier gezeigt ist als Beispiel ein liganden-gesteuerter Ionenkanal, der durch Bindung von cyclischen Nukleotiden (cNMP) an den im Zellinneren gelegenen C-Terminus aktiviert wird. | 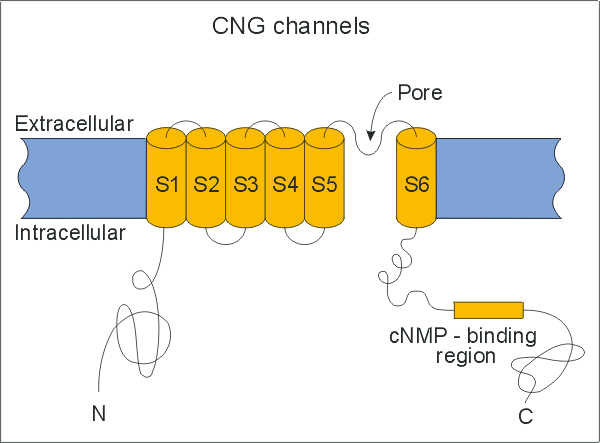
|
| Die Porenregion | HIGHRES (77 kbyte) |
|---|---|
| Die erste Raumstruktur eines Ionenkanals ist kürzlich aufgeklärt worden (Doyle et al., 1998) und ist hier sehr schematisch dargestellt. Hydratisierte K+-Ionen gelangen vom Zytoplasma her in die Pore bis zu einer Höhlung in der Mitte des Kanalproteins. In die engste Stelle der Pore - den Selektivitätsfilter - gelangen die Ionen nur nach Abstreifen der Wassermoleküle. In den beiden Bindestellen des Selektivitätsfilters kommt es zu einer elektrostatischen Wechselwirkung von Ion und polaren Gruppen des Proteins. Diese Bindung ersetzt die Bindung an Wassermoleküle und ermöglicht es dem Ion, die Pore zur Zellaußenseite hin zu verlassen. | 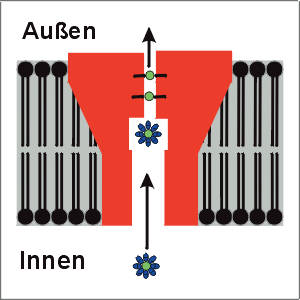
|