Dargestellt sind Toxine aus den Jagdgiften von und

| Die Conotoxin-Familien | HIGHRES (70 kbyte) |
|---|---|
| Primärstruktur jeweils eines Mitglieds von 5 Conotoxinfamilien. Die Toxine werden nach gemeinsamen Zielproteinen im Beuteorganismus gruppiert: a -Conotoxine binden an nicotinische Acetylcholinrezeptoren, m-Conotoxine an muskuläre Na+ Kanäle, w-Conotoxine an neuronale Ca2+ Kanäle, d-Conotoxine an neuronale Na+ Kanäle und k-Conotoxine and neuronale K+ Kanäle. Ein spezifische Muster von Disulfidbrückenbindungen (schwarze Linien) kennzeichnet die Struktur einer jeden Familie. Dargestellt sind Toxine aus den Jagdgiften von und |  |
| Die Struktur von w-Conotoxin | HIGHRES (99 kbyte) |
|---|---|
| Strukturmodell eines w-Conotoxins aus dem Gift von . Die einzelnen Aminosäurereste sind mit den üblichen Ein-Buchstaben-Symbolen angegeben (Symbol O: Hydroxyprolin). Disulfidbrücken zwischen jeweils zwei Cysteinresten (Symbol C) sind durch schwarze Balken dargestellt. Die Disulfidbrücken festigen die Raumstruktur dieser kleinen Peptide und sind für die biologische Wirkung unbedingt notwending. Die meisten Conotoxine sind kleine Peptide von nur 10 bis 30 Aminosäuren. Vermutlich besteht der wichtigste Vorteil dieser geringen Größe darin, daß die Toxinmoleküle schnell durch die Gewebsflüssigkeit der Beutetiere diffundieren und damit eine raschere Lähmung bewirken können. | 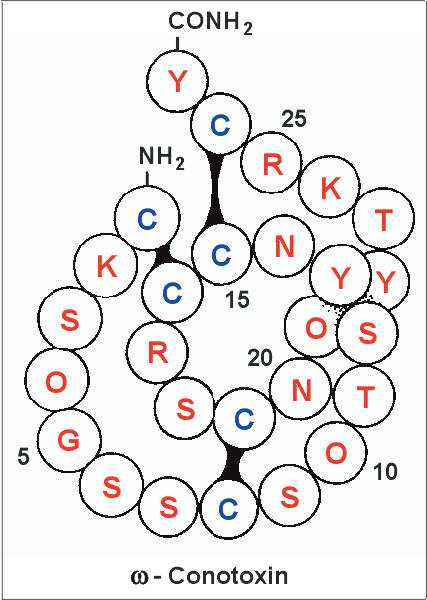 |